Alors que l’incidence du cancer (nouveaux cas diagnostiqués) par tranche d’âge reste relativement stable, le nombre total de personnes atteintes (prévalence) augmente rapidement : en cause, la régression de mortalité par maladies cardio-vasculaires, le vieillissement de la population… et la meilleure survie des patients atteints de cancer. Le nombre de nouveaux traitements du cancer ne cesse de s’accélérer, avec des résultats impressionnants ! Ainsi, en une vingtaine d’année, la probabilité de survie à 5 ans après un diagnostic de cancer chez l’adulte est passée globalement de 55% à 65%.
Les nouveaux traitements peuvent être classés en deux grandes catégories:
- L’immunothérapie, dont nous allons parler aujourd’hui
- Les thérapies ciblées, dont nous parlerons prochainement.
Cela fait des dizaines d’années que les chercheurs consacrent des ressources importantes pour essayer de traiter les cancers par le biais des défenses immunitaires. Il a ainsi été démontré que les cancers expriment des antigènes tumoraux qui peuvent être reconnus par le système immunitaire. Par exemple, des approches de vaccination contre ces antigènes ont été développées chez les patients cancéreux, avec l’objectif que ces derniers développent des réponses immunitaires contre leur tumeur, comme ils le feraient contre les antigènes du tétanos ou de la grippe, après vaccination. Ces approches ont permis d’induire des régressions tumorales, validant ainsi le concept. Mais ces réponses ne concernaient qu’un pourcentage restreint de patients ; de plus, la durée de ces réponses est restée décevante.
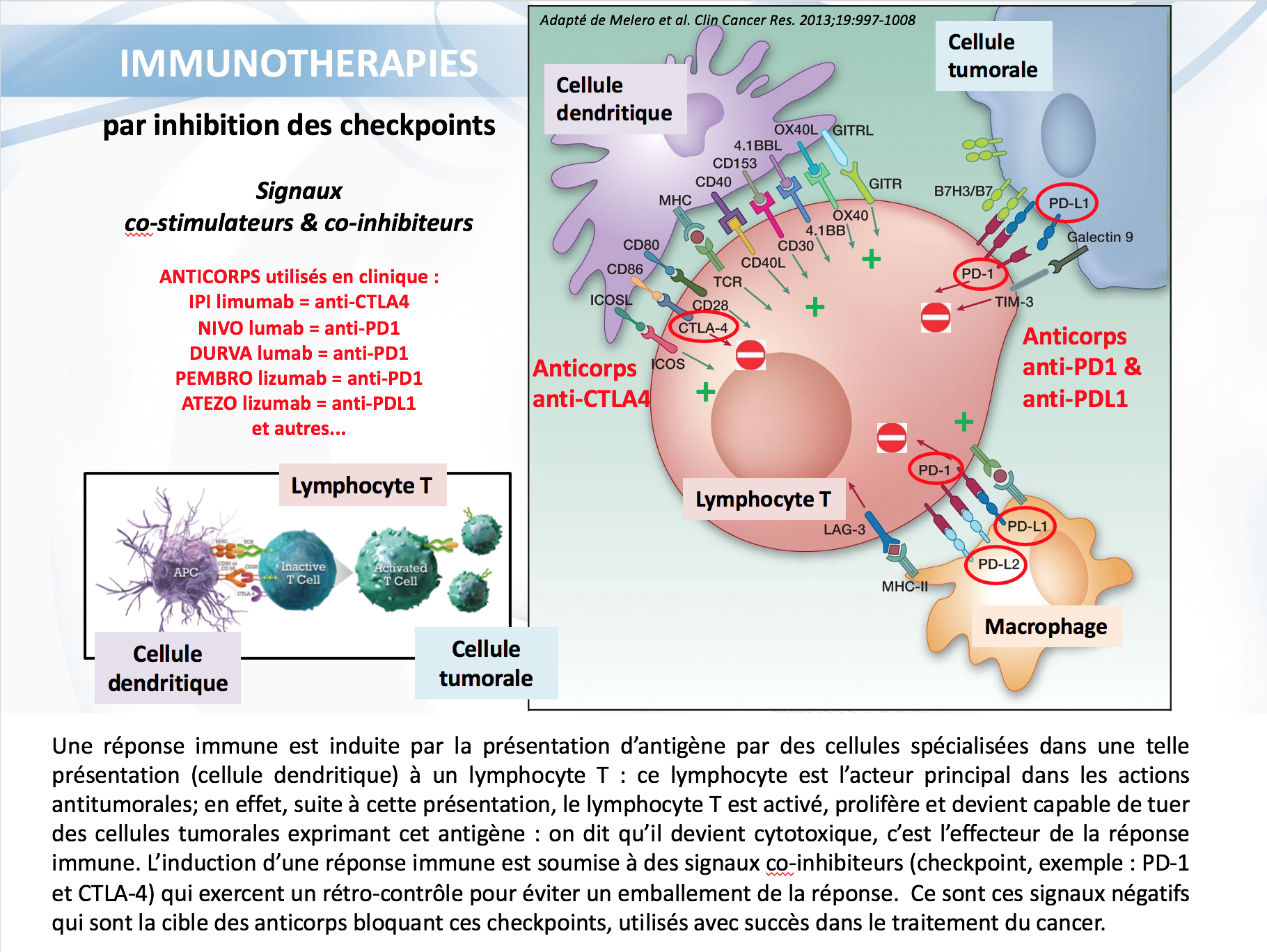
Les réponses exceptionnelles des immunothérapies décrites ces dernières années sont le résultat d’une autre approche : de façon générale, une réponse immune se développe suite à la « présentation » d’antigènes aux lymphocytes, qui vont commencer à proliférer en très grand nombre. L’organisme a développé des mécanismes de freinage (rétro-contrôle), afin d’éviter un emballement exagéré de cette réponse : ce freinage survient au niveau de « point de contrôle » immunitaire, que l’on appelle aussi « checkpoint » sur base de la terminologie anglaise. Ces points de contrôle sont le résultat de l’interaction entre une protéine présente à la surface des lymphocytes (exemple PD-1) et une autre présente à la surface des cellules interagissant avec ces derniers (exemple PDL-1). Un autre point de contrôle, donné à titre d’exemple, correspond à l’interaction entre CTLA-4 et B7.1 et B7.2.
La stratégie qui engendre actuellement des succès inouïs dans le traitement du cancer consiste à bloquer ces points de contrôle des réponses immunes (« checkpoint inhibiteurs »), par l’utilisation d’anticorps monoclonaux (produits par biotechnologie) ciblant l’une ou l’autre de ces protéines. Pour dire les choses autrement, la stratégie consiste à bloquer un système physiologique inhibant les réponses immunes, ce qui revient finalement à les activer. A titre d’exemple, le blocage de PD-1 a été obtenu par les anticorps pembrolizumab, nivolumab, et dostarlimab, et celui de PD-L1 par les anticorps atezolizumab, avelumab et durvalumab.
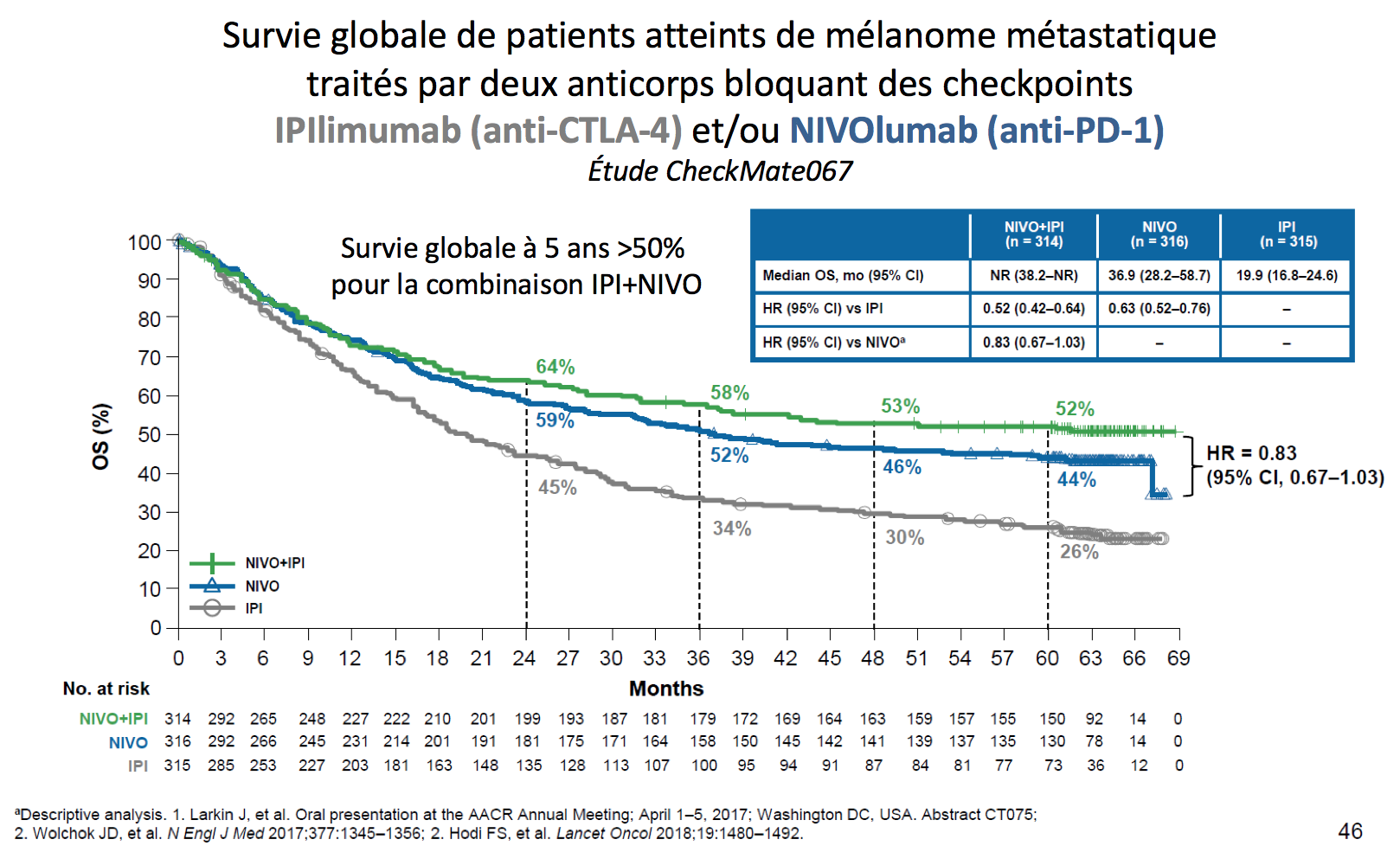
Les immunothérapies par administration de ces anticorps permettent d’induire des réponses tumorales et des survies dans des situations cliniques où le pronostic était parfois exécrable. A titre d’exemple, la survie des patients atteints de mélanome métastatique atteint actuellement 50%, alors qu’elle était précédemment de moins de 5% (voir figure). Le nombre d’indications augmente rapidement (voir tableau).
Pour ceux qui veulent en savoir un peu plus…
Prenons l’exemple le plus connu de PD-1 et PDL-1.
PD-1 (« Programmed cell death 1) est une protéine transmembranaire présente sur des cellules du système immunitaire : les lymphocytes T, les lymphocytes B et les cellules NK. PD-1 est une molécule inhibitrice qui se lie à PDL-1 (« Programmed cell death ligand 1)) et PDL-2.
PDL-1 est exprimé à la surface de nombreux types cellulaires, y compris beaucoup de cancers différents.
L’interaction entre PD-1 et PDL-1 inhibent directement la mort (apoptose) de la cellule tumorale, favorise l’extinction des lymphocytes T périphériques effecteurs, et stimule la conversion de ces cellules effectrices en cellules des régulateurs (Treg).
En général, l’expression de PD-1 et PD-L1/L2 est élevée en présence de cytokines pro effectrices, comme l’interleukine 12 et l’interféron gamma, soulignant leur rôle dans le rétro-contrôle physiologique de la fonction effectrice de lymphocytes T cytotoxiques.
Des anticorps monoclonaux ont été développés par biotechnologie pour bloquer spécifiquement soit PD-1, soit PD-L1. De nombreuses études ont montré que l’administration aux patients de ces anticorps permet d’induire des régressions tumorales durables, et augmente leur survie, dans un nombre de plus en plus grand de tumeurs.
Pr Thierry Velu, Oncologue et Directeur du Chirec Cancer Institute
> Découvrez tous les spécialistes œuvrant pour le Chirec Cancer Institute